1. 什么是大π键?
在多原子分子中,如有相互平行的p轨道,
它们连贯重叠在一起构成一个整体,p电子
在多个原子间运动形成π型化学键,这种
不局限在两个原子之间的π键称为离域π
键或共轭大π键。
2. 形成大π键的条件是什么?
1.这些原子都在同一平面上;
2.这些原子有相互平行的p轨道;
3.p轨道上的电子总数小于p轨道数
的2倍。
3. 如何表示大π键?
如
指平行于p轨道的数目有3个(一般粒子有几个原子,就是几个p轨道),平行p轨道里的电子数为4。
4. 如何计算大π键中的电子数?
1.确定分子中总价电子数;
2.计算分子中的
键和不与π键p轨
道平行的孤对电子(含中心和外围中的
电子数);
3.总电子数减去这些
键和孤对电子,剩余的就是填入大π键的电子。
5. 举例说明?
例1:CO2中的大π键:
分析:(1)CO2中C原子为sp杂化,两端的O原子可视为不杂化。
(2)C原子sp杂化轨道为两个能量相等的Px轨道,其中各含有1个成单电子;Py轴上有1个成单电子;Pz轴上也有1个成单电子。
(3)O原子2s2、2P轨道中其中一个轨道上面均为两个自旋相反的电子。另两个P轨道上的成单电子分别与C原子的sp杂化轨道形成
键和π键。
(4)第一套:y轴从左至右的电子数为:1、1、2,共4e—;第二套:z轴从左至右的电子数为:2、1、1,共4e—;均为三个P轨道,故CO2中存在两套
的大π键。
另计算如下:(中心原子C不存在孤对电子)
(1)CO2中的价电子总数为4+6×2=16。
(2)C与O形成
键的电子数为2×2=4。(C和O各拿出1个电子,共2组)
(3)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),2个O原子共有:4×2=8。
(4)形成大π键的电子,即为剩余电子,共有:16-4-8=4。
(5)O、C、O的每个原子的某一p轨道中共有4个电子可共享,即大π键为
。
例2:NO3—中的大π键:(中心原子N不存在孤对电子)
(1)NO3—中的价电子总数为5+6×3+1=24。
(2)N与O形成
键的电子数为3×2=6。(N和O各拿出1个电子,共3组)
(3)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),3个O原子共有:4×3=12。
(4)形成大π键的电子,即为剩余电子,共有:24-6-12=6。
(5)O、O、N、O原子的每个原子的某一p轨道中共有4个电子可共享,即大π键为
。
例3:O3中的大π键:(中心原子O存在一对孤对电子)O3可以看成O·O2。
(1)O3中的价电子总数为6×3=18。
(2)中心O与另两个O原子形成
键的电子数为2×2=4。
(3)中心O存在一对孤对电子。
(4)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),2个O原子共有:4×2=8。
(5)形成大π键的电子,即为剩余电子,共有:18-4-2-8=4。
(6)3个原子的每个原子的某一p轨道中共有4个电子可共享,即大π键为
。
提醒:中心原子若有孤对电子,一定要把孤对电子从价电子总数中减去。
说明:如果能画出草图,则可更好地理解各个原子之间的成键情况。如果画不出,只能通过公式进行计算,而不必管电子是如何填入轨道中的。
归纳:可以简单的计算如下:
(1)先计算粒子的总价电子数(m);
(2)计算原子之间的
键,一对键
存在2个电子(n);
(3)中心原子的孤对电子数(o);
(4)外围原子的价层电子中的孤对电子数,如O原子为2s、2p中各有1对,共4个电子(p)。
(5)大π键的电子,剩余电子,共有:b=m-n-o-p。
(6)表示:共有几个原子参加,则即有几个p轨道平行,数目为a,大π键表示为:
。
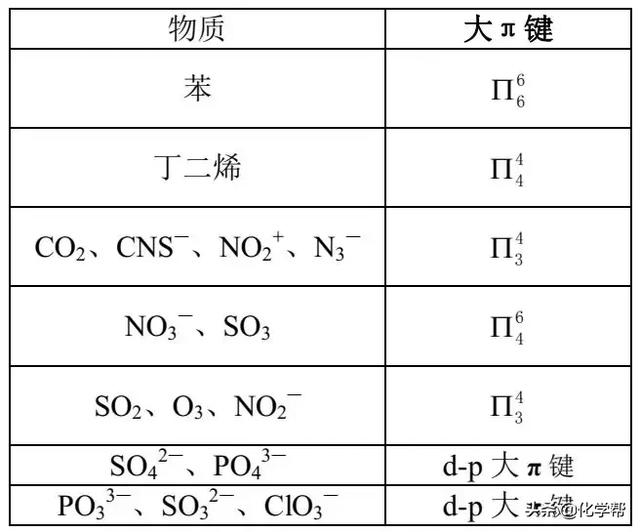
6. 常见物质中的大π键?
本站内容收集整理于网络,多标有原文出处,本站仅提供信息存储空间服务。如若转载,请注明出处。