作者:新一学姐
金属及其化合物在高考大纲中重点要求的主要是掌握钠、镁、铝、铁、铜等元素及其化合物的主要性质和重要应用;了解金属材料在生产和生活中的重要应用;理解金属发生电化学腐蚀的原因,能运用恰当的措施防止铁、铝等金属腐蚀.如何更好地掌握它们的知识要点并能够应用到具体的高考化学试题中是我们应该关注的热点之一,下面我们将金属及其化合物进行整体剖析及方法论总结。
1、典型元素及其化合物的转化关系
(1)钠及其化合物间的转化关系
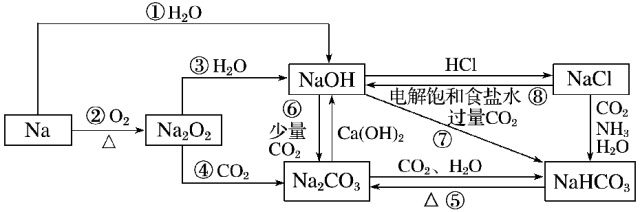



















本站内容收集整理于网络,多标有原文出处,本站仅提供信息存储空间服务。如若转载,请注明出处。






