物理学四大力学中,热力学独具魅力。热力学四大定律如同建筑物的基石一般,支撑起了一个让人们可以“针对热学现象基于演绎推理的逻辑”进行理论描述的科学知识体系。这个体系是如此简洁、丰富,以至于它和牛顿力学一样,成为大学物理学教育中最基础、最重要的部分。在热力学理论的形成过程中,以理查兹、能斯特为代表的从事物理化学研究的化学家们在热力学第三定律提出时扮演了重要的角色。但现有教材在讲到此部分内容时,对知识点的关注比较多,对历史的介绍相对少一些。文章拟针对这段历史进行回顾,并就热力学第三定律的物理内涵展开一些讨论。希望通过这个总结,为物理、化学、材料科学等学科专业的同学们在学习热力学第三定律时提供一个不一样的视角。进而,能够更为全面地理解自然界的奇妙以及人们认识自然规律时简单逻辑的重要性,体会科学研究中不同学科之间交叉互融的作用。
撰文 | 邓妙怡 (北京大学前沿交叉学科研究院 科学技术与医学史系)、李新征 (北京大学物理学院)1
引 子 爱因斯坦曾这样评价热力学理论体系:“越简单、内容越丰富、适用范围越广的理论越让人印象深刻,经典热力学就是这样的理论,我认为它是唯一的一个基本原理从未被推翻的具有普适性的物理学理论”[1,2]。 在热力学的四大定律中,第三定律非常特殊。它是由19世纪末、20世纪初物理与化学学科发展的交叉互融所产生的重要成果。历史上,该定律由化学家能斯特 (Walther Hermann Nernst,1864-1941) 提出,早期被称为能斯特热定理 (Nernst heat theorem) 1)。能斯特因此获得1920年的诺贝尔化学奖[3]。后来,能斯特热定理被命名为热力学第三定律。相较于热力学第一、第二定律及之后被总结出的第零定律,热力学第三定律具有明确的量子力学内涵2)。实际上,能斯特就是与量子力学的发展密切相关的索尔维会议的关键发起人。在热力学第三定律的产生过程中,美国化学家理查兹 (Theodore William Richards,1868—1928) 3)同样发挥了重要作用。理查兹是当时一种很精确的绝热量热计 (calorimeter) 的发明人,也是关于化学反应热的研究中极其重要的量热法 (calorimetry) 技术变革的引领者。这些精确测量化学反应中关键物理量的实验技术的发展及电化学实验输出功的测量,是热力学第三定律能够被提出的基础4)。 或许正是因为热力学第三定律的发现是由物理与化学的学科交叉进而兴起的物理化学学科的发展所导致的,时至今日,在物理学教学中关于其产生的历史过程与物理内涵的论述与第一和第二定律相比,较为缺乏。多数教材在讲述这部分内容时是直接交代其物理结论。这不仅淡化了该定律诞生过程中丰富的科学史的内容[3—5],也会导致读者忽视热力学第三定律背后的一些关键物理内涵。比如,热力学第三定律与量子力学的关系。再比如,为什么人们是基于化学反应的研究来定量测量两个热力学平衡态之间的自由能差的?而关于这些问题的认识,对理解热力学第三定律具有重要意义。科学史方面,现有关于热力学第三定律的材料多围绕着能斯特本人的经历展开[3]。显然,热力学第三定律作为被爱因斯坦称为有“永恒”魅力的理论定律,其产生过程背后的自然科学学科发展的规律更值得推敲[4—5]。 本文拟对热力学第三定律的产生过程进行回顾,重点讲述从19世纪下半叶开始人们利用热力学理论对化学反应的研究,以及热力学第三定律的内涵,特别是它与经典理论、量子理论的关系。我们希望通过这篇文章,为物理、化学、材料科学等学科专业的同学,在学习热力学第三定律时提供一个不一样的视角。2
19世纪末的热力学理论 在热力学发展史上,热力学第三定律是按时间顺序出现的第三个定律,其完整表述为:当热力学温度趋近于绝对零度(T=0 K)时,热力学系统的熵趋于定值[6,7]。对“熵”的认识作为热力学第二定律的核心内容,是第三定律的逻辑基础。因此,热力学第三定律是在第二定律的基础上提出的,但第二定律关注的是平衡态热力学过程中的“熵变”,而不是“熵值”,第三定律关注的是某系统在“绝对零度”下的“熵值”。 “绝对零度”作为热力学第三定律中的一个关键词,不禁让人联想到19世纪末至20世纪初低温技术的发展。但实际上,在发现第三定律的过程中,起到最关键推动作用的,并非是低温技术与低温物理的研究,而是为理解化学反应的热力学机制的研究。其中,理查兹在1902年文章中的电化学反应实验数据都在零摄氏度以上;1905-1906年,能斯特在其提出能斯特定理的工作中,关键的出发点,也就是化学反应输出功 (自由能变化) 及化学反应热 (焓变) 对温度的斜率在绝对零度时为零,仅仅是个猜测[8]。由此猜测出发,他推导出化学反应的熵变在接近绝对零度时趋近于零,即能斯特定理。这正是热力学第三定律发现过程中的奇妙之处。虽然第三定律讲的是绝对零度的性质,但其发现过程中所依赖的实验研究却与低温无关,甚至相关实验数据都在零摄氏度以上。但理查兹、能斯特进行的思考,是关于绝对零度附近的行为。更有趣的是,在1906年以后,能斯特的确做了很多低温实验想从实验数据的角度为这个的定理提供力证,但这些实验的数据并不干净,反而无法提供支持。这是因为当时人们测量化学反应的自由能变化只有两条路:一条是利用化学反应平衡常数,在稀释极限下展开测量,这个实验难度是极高的;另一条路是借助于电化学反应,但因为需要溶液,一般的温度不能太低。 接下来,我们将基于热力学第二定律回顾热力学平衡态描述的基本理论。这些基本理论主要来自吉布斯 (Josiah Willard Gibbs) 与亥姆霍兹 (Hermann von Helmholtz) 。其中,吉布斯精通理论物理和理论化学 (物理化学) ,他的理论由三个工作共计4篇文章组成[9-12] 5)。亥姆霍兹最早学习医学,后期转到了电化学机制与热力学理论的研究。二人提出的理论很类似,尽管亥姆霍兹的理论提出时间比吉布斯晚十年左右,但两者具备独立性。主要区别在于亥姆霍兹的理论针对等温等容的体系,而吉布斯针对等温等压体系,这造成了两者的自由能差异,分别是亥姆霍兹自由能 (U-TS) 与吉布斯自由能(U+PV-TS)。 1873年,吉布斯的第一篇经典之作发表。他在克劳修斯的工作基础上,对简单液体的平衡态热力学性质展开讨论。文章题目是“Graphical methods in the thermodynamics of fluids”,这里的关键词是graphical methods,他将: 改写为 此改动背后的物理思想非常深刻。正如美国数学史专家Morris Kline所说,吉布斯从热力学基础中,剔除了热和功,用状态函数取而代之,从而使热力学成为描述平衡态物质特性的理论。并且,吉布斯提出人们可以用几何的方法对一个热力学体系进行描述,即基于S、V等热力学状态函数,用图的形式来描述一个热力学系统的状态变化6)。 在这篇文章的基础上,吉布斯在同年发表的第二篇文章 (“A method of geometrical representation of the thermodynamic properties of substances by means of surfaces”) 中,引入U作为第三个维度。以U为z轴,S、V等热力学状态函数为x—y平面,这时系统的热力学状态可以描述为曲面。这篇文章提出了基于偏微分的方法,由曲面几何来描述物质热力学性质的思想7)。在这个三维空间、二维曲面形成的图像中,公式2中的温度T、压强P等于: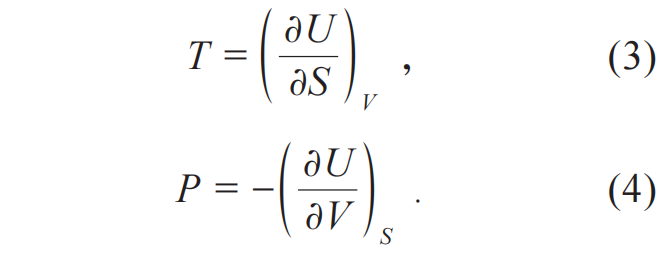 同时,他将
定义为自由能,并指出它描述的是一个等温等压热力学系统对外做非体积功的能力。可以看到,热力学第二定律中的熵在(5)式中已有体现。
从科学史的视角回溯,自由能概念的认识对热力学第三定律的诞生意义非凡。热力学第三定律发现过程中的关键物理量由此确立。热力学第三定律发现的实验基础 (理查兹工作中用到的实验数据),正是围绕自由能这一核心物理量展开。最后需要说明的是,除了上述(U, S, V),即用S、V热力学状态函数描述热力学势U形成三维图像的组合,通过勒让德变换,还可以得到(H, S, P)与(G, T, P)。若将公式(5)的吉布斯自由能改为亥姆霍兹自由能(F=U-TS),也可以得到(F, T, V)。这就带来了热力学量之间一系列严格的用偏微分联系起来的等价关系。考虑到这部分内容在很多教材上介绍得很系统,本文重点是热力学第三定律,这里我们仅将后面推导中要用到的两个关系列出:
同时,他将
定义为自由能,并指出它描述的是一个等温等压热力学系统对外做非体积功的能力。可以看到,热力学第二定律中的熵在(5)式中已有体现。
从科学史的视角回溯,自由能概念的认识对热力学第三定律的诞生意义非凡。热力学第三定律发现过程中的关键物理量由此确立。热力学第三定律发现的实验基础 (理查兹工作中用到的实验数据),正是围绕自由能这一核心物理量展开。最后需要说明的是,除了上述(U, S, V),即用S、V热力学状态函数描述热力学势U形成三维图像的组合,通过勒让德变换,还可以得到(H, S, P)与(G, T, P)。若将公式(5)的吉布斯自由能改为亥姆霍兹自由能(F=U-TS),也可以得到(F, T, V)。这就带来了热力学量之间一系列严格的用偏微分联系起来的等价关系。考虑到这部分内容在很多教材上介绍得很系统,本文重点是热力学第三定律,这里我们仅将后面推导中要用到的两个关系列出:
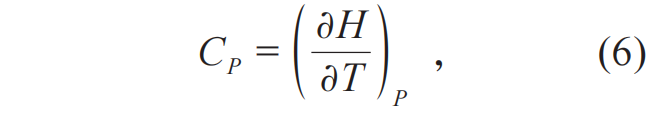 与
与
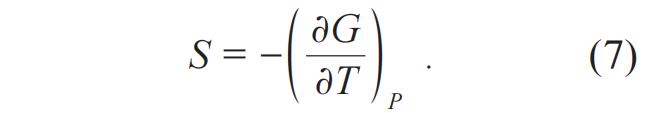 更为系统的内容请读者翻阅文献[6,7]。
基于上述两项工作,描述一个热力学系统的图形化工具便已具备。1875—1878年,吉布斯又针对混合液体,完成了被称为“吉布斯热力学三部曲”第三个工作,题为“On the equilibrium of heterogeneous substances”,分两次发表。这两篇论文的主体,是关于复相体系 (包括单元复相与多元复相) 热平衡的讨论。文章的关键词,是equilibrium和heterogeneous substances。化学势在描述平衡过程中扮演了重要的角色。“相”的概念也在这个工作中被正式提出8)[13](关于相的详细讨论可参考文献[6]第二至第四章)。
上述吉布斯的工作,指出自由能可以用来描述一个热力学系统对外做非体积功的能力[12]。后来,人们认识到化学反应都会向着自由能降低的方向进行9)。然而,受历史因素影响,吉布斯的观点真正为欧洲主流学界接受却是在十年之后。在这个时间点,亥姆霍兹的系列工作也已发表。为了明确自由能是可以做功的能量,亥姆霍兹还引入了bound energy的概念10),它对应的是G或者F中的TS项,是不能被转换为功的。至此,到了19世纪末,人们已经可以将一个热力学系统对外做功与其自由能变化联系起来,将其吸收或放出热量与其焓变联系起来11)。这也为下一步人们基于对化学反应的热力学研究发现热力学第三定律奠定了坚实的理论基础12)。
更为系统的内容请读者翻阅文献[6,7]。
基于上述两项工作,描述一个热力学系统的图形化工具便已具备。1875—1878年,吉布斯又针对混合液体,完成了被称为“吉布斯热力学三部曲”第三个工作,题为“On the equilibrium of heterogeneous substances”,分两次发表。这两篇论文的主体,是关于复相体系 (包括单元复相与多元复相) 热平衡的讨论。文章的关键词,是equilibrium和heterogeneous substances。化学势在描述平衡过程中扮演了重要的角色。“相”的概念也在这个工作中被正式提出8)[13](关于相的详细讨论可参考文献[6]第二至第四章)。
上述吉布斯的工作,指出自由能可以用来描述一个热力学系统对外做非体积功的能力[12]。后来,人们认识到化学反应都会向着自由能降低的方向进行9)。然而,受历史因素影响,吉布斯的观点真正为欧洲主流学界接受却是在十年之后。在这个时间点,亥姆霍兹的系列工作也已发表。为了明确自由能是可以做功的能量,亥姆霍兹还引入了bound energy的概念10),它对应的是G或者F中的TS项,是不能被转换为功的。至此,到了19世纪末,人们已经可以将一个热力学系统对外做功与其自由能变化联系起来,将其吸收或放出热量与其焓变联系起来11)。这也为下一步人们基于对化学反应的热力学研究发现热力学第三定律奠定了坚实的理论基础12)。
3
化学反应中的热力学研究及热力学第三定律的发现 如前所述,热力学第三定律的内容是当热力学温度趋近于绝对零度(T=0 K)时,热力学系统的熵趋于定值。言下之意,当系统处在一个恒定的温度下,它可以有两个平衡热力学状态A和B,A与B的熵会不同。但是,在绝对零度时,A与B两个热力学状态的熵一定相等。用公式的形式表达,就是: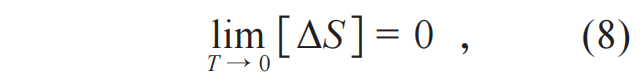 ΔS是温度T时这个系统的两个热力学平衡态的熵的差。具体定义为
ΔS是温度T时这个系统的两个热力学平衡态的熵的差。具体定义为
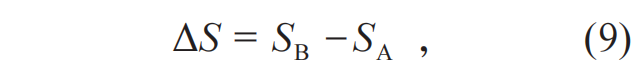 相应,也有:
相应,也有:
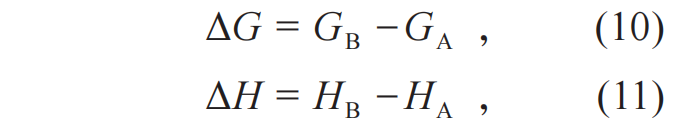 为了得到公式(8),关键是对同一个系统在温度T下的两个热力学平衡态的热力学量的差的测量。化学反应恰恰提供了这样一个平台。在恒定温度T下,如果可以对一个热力学系统在化学反应的反应态与生成态的热力学量的差值 (如ΔG、ΔH) 进行定量测量,就可以得到公式(8)的结论。
正因如此,19世纪末至20世纪初,在物理化学这个新兴的学科领域,人们通过热力学对化学反应的研究促成了热力学第三定律的诞生。ΔG与化学反应做非体积功有关,ΔH与热有关13)。正是基于人们在实验上进行的对ΔG、ΔH等关键热力学量的测量,理查兹和能斯特先后意识到它们在低温下会具有一些特殊的性质。1902年,理查兹通过收集文献中关于化学反应的自由能变化以及焓变的数据,将其绘制成温度的函数,如图1所示[14]。需要说明的是,这些反应都是电化学反应,理查兹用到的实验数据都是0 ℃以上的实验数据,低温下的图像完全是通过外推得到的。由此图,理查兹得出了:
为了得到公式(8),关键是对同一个系统在温度T下的两个热力学平衡态的热力学量的差的测量。化学反应恰恰提供了这样一个平台。在恒定温度T下,如果可以对一个热力学系统在化学反应的反应态与生成态的热力学量的差值 (如ΔG、ΔH) 进行定量测量,就可以得到公式(8)的结论。
正因如此,19世纪末至20世纪初,在物理化学这个新兴的学科领域,人们通过热力学对化学反应的研究促成了热力学第三定律的诞生。ΔG与化学反应做非体积功有关,ΔH与热有关13)。正是基于人们在实验上进行的对ΔG、ΔH等关键热力学量的测量,理查兹和能斯特先后意识到它们在低温下会具有一些特殊的性质。1902年,理查兹通过收集文献中关于化学反应的自由能变化以及焓变的数据,将其绘制成温度的函数,如图1所示[14]。需要说明的是,这些反应都是电化学反应,理查兹用到的实验数据都是0 ℃以上的实验数据,低温下的图像完全是通过外推得到的。由此图,理查兹得出了:
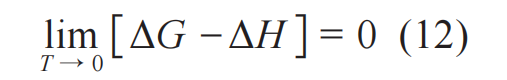 的结论。这是热力学第三定律发现过程中关键的第一步。之后,由于恒温化学反应的ΔG、ΔH、ΔS满足:
结合公式(12),就可得:
公式(12)—(14)描述的ΔG、ΔH在低温下可以有不同的温度依赖关系,如图2所示。对这个趋近行为的描述促成了热力学第三定律发现过程中最关键的第二步。
的结论。这是热力学第三定律发现过程中关键的第一步。之后,由于恒温化学反应的ΔG、ΔH、ΔS满足:
结合公式(12),就可得:
公式(12)—(14)描述的ΔG、ΔH在低温下可以有不同的温度依赖关系,如图2所示。对这个趋近行为的描述促成了热力学第三定律发现过程中最关键的第二步。
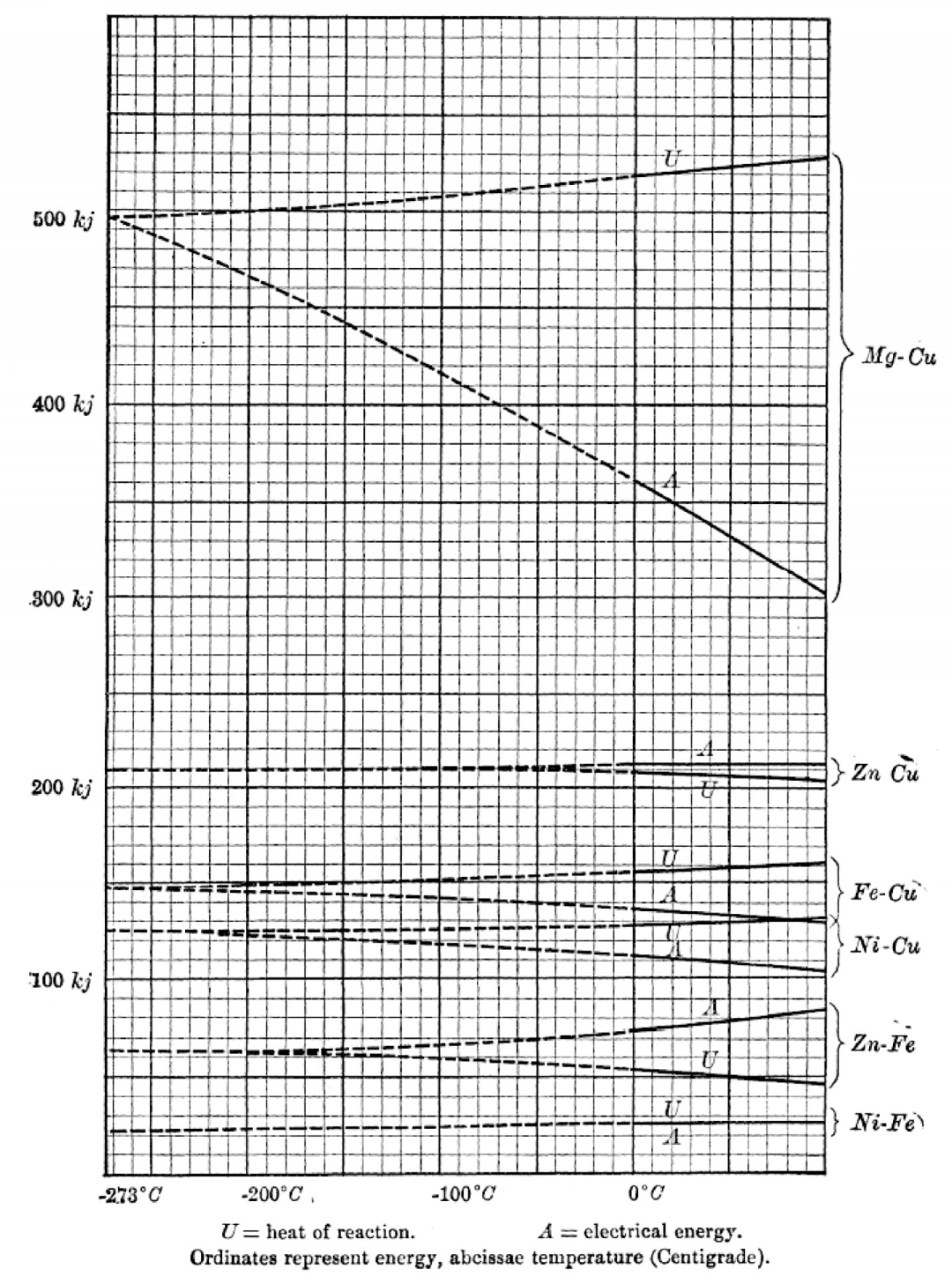 图1 文献[14]中理查兹的数据原图。图中heat of reaction(U)与electrical energy(A)分别对应化学反应焓变ΔH与自由能变化ΔG。前者对应ΔH是因为焓的意义就是热;后者对应ΔG是因为电化学反应的有用功均以电能的形式输出。实线是实验数据支持的部分,虚线为理查兹进行的外推。本图用到的实验数据对应的温度都在0 ℃以上(0 ℃以上的线为实线)
图1 文献[14]中理查兹的数据原图。图中heat of reaction(U)与electrical energy(A)分别对应化学反应焓变ΔH与自由能变化ΔG。前者对应ΔH是因为焓的意义就是热;后者对应ΔG是因为电化学反应的有用功均以电能的形式输出。实线是实验数据支持的部分,虚线为理查兹进行的外推。本图用到的实验数据对应的温度都在0 ℃以上(0 ℃以上的线为实线)
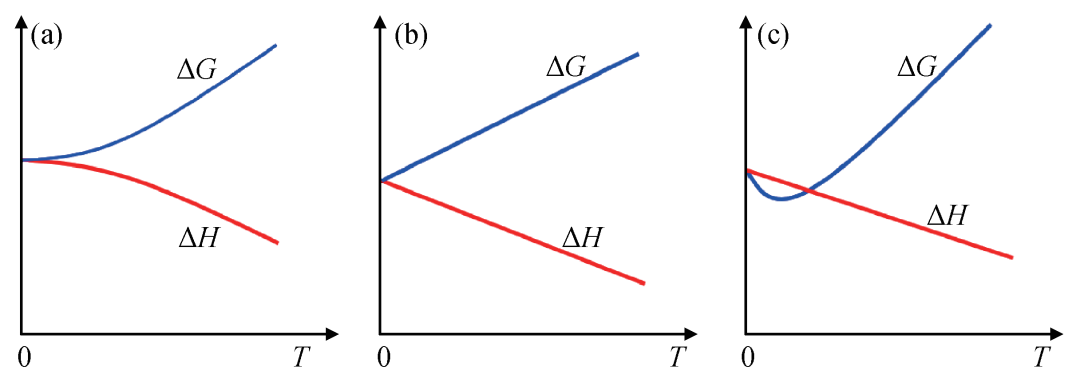 图2 在接近绝对零度时,ΔG、ΔH 有不同的趋近行为
在能斯特之前,哈伯 (Fritz Haber,1968-1934)、范特霍夫 (Jacobus Henricus van’t Hoff,1852-1911) 在1904与1905年也关注过这个问题。遗憾的是,他们对这个趋近行为的理解是定性错误的,从而错过了热力学第三定律的发现。以范特霍夫为例,他认为化学反应的焓变在温度趋近于绝对零度是呈线性依赖温度的变化(图2(b))[5]。与他们不同,在1905年末到1906年这个时间节点,能斯特提出ΔH与ΔG对温度的斜率在趋近绝对零度时为0[8],即:
图2 在接近绝对零度时,ΔG、ΔH 有不同的趋近行为
在能斯特之前,哈伯 (Fritz Haber,1968-1934)、范特霍夫 (Jacobus Henricus van’t Hoff,1852-1911) 在1904与1905年也关注过这个问题。遗憾的是,他们对这个趋近行为的理解是定性错误的,从而错过了热力学第三定律的发现。以范特霍夫为例,他认为化学反应的焓变在温度趋近于绝对零度是呈线性依赖温度的变化(图2(b))[5]。与他们不同,在1905年末到1906年这个时间节点,能斯特提出ΔH与ΔG对温度的斜率在趋近绝对零度时为0[8],即:
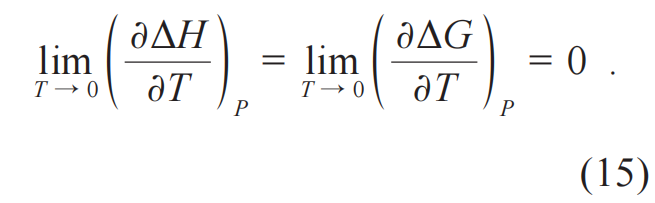 从这个公式出发,能斯特能够得出两个推论。第一个来自(∂ΔH/∂T)P=0,其中ΔH=HB-HA。这时,可以利用公式(6)得到:
从这个公式出发,能斯特能够得出两个推论。第一个来自(∂ΔH/∂T)P=0,其中ΔH=HB-HA。这时,可以利用公式(6)得到:
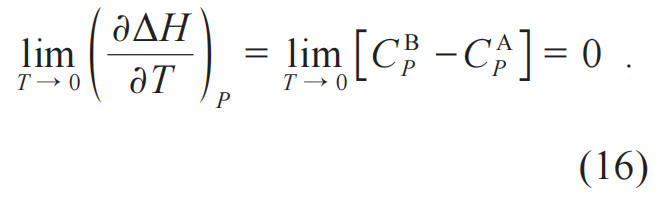 这意味着化学反应体系处在生成物状态时相对于处在反应物状态时,比热不发生变化。第二个来自(∂ΔG/∂T)P=0,其中ΔG=GB-GA。这时,就可以利用公式(7)得到:
这意味着化学反应体系处在生成物状态时相对于处在反应物状态时,比热不发生变化。第二个来自(∂ΔG/∂T)P=0,其中ΔG=GB-GA。这时,就可以利用公式(7)得到:
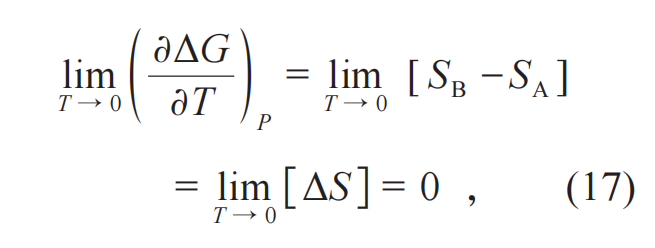 这意味着化学反应体系处在生成物状态时相对于处在反应物状态时的熵也不发生变化。公式(8)也就相应得证。
如果进一步把公式(8)的结论扩展到这个系统的任何两个热力学平衡态之间的熵差在温度趋近于绝对零度时为零,就是热力学第三定律的表述了。它等价于:当热力学系统趋于绝对零度时,熵趋于定值。这样的话,也可以用“一个热力学系统的温度无法通过有限次操作降至绝对零度”来进行表述 (图3)。需要说明的是,公式(8)是以公式(15)为出发点导出的,因此它早期被称为能斯特热定理。但此出发点在热力学理论框架下是一个不能被证明的假设 (尽管能斯特做过很多努力)。后期,人们意识到它应该被赋予独立的、基础的逻辑地位,即定律 (Law) 的地位。因此,公式(8)最终被改称为热力学第三定律。1905年12月、1906年12月,能斯特分别在哥廷根和柏林的两个会议上提交了文章来报道这些工作14),人们也将热力学第三定律的发现主要归功于能斯特。
这意味着化学反应体系处在生成物状态时相对于处在反应物状态时的熵也不发生变化。公式(8)也就相应得证。
如果进一步把公式(8)的结论扩展到这个系统的任何两个热力学平衡态之间的熵差在温度趋近于绝对零度时为零,就是热力学第三定律的表述了。它等价于:当热力学系统趋于绝对零度时,熵趋于定值。这样的话,也可以用“一个热力学系统的温度无法通过有限次操作降至绝对零度”来进行表述 (图3)。需要说明的是,公式(8)是以公式(15)为出发点导出的,因此它早期被称为能斯特热定理。但此出发点在热力学理论框架下是一个不能被证明的假设 (尽管能斯特做过很多努力)。后期,人们意识到它应该被赋予独立的、基础的逻辑地位,即定律 (Law) 的地位。因此,公式(8)最终被改称为热力学第三定律。1905年12月、1906年12月,能斯特分别在哥廷根和柏林的两个会议上提交了文章来报道这些工作14),人们也将热力学第三定律的发现主要归功于能斯特。
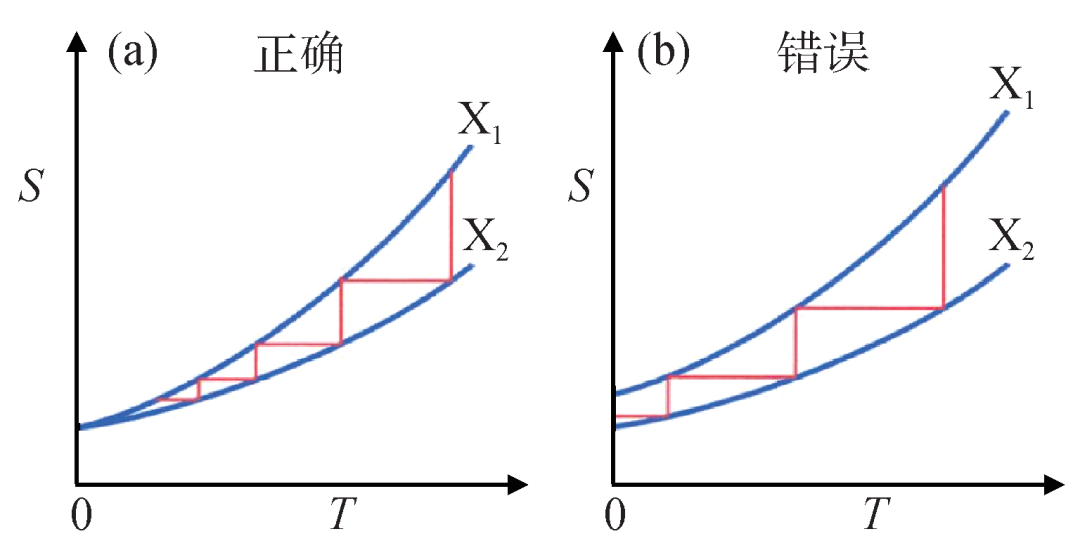 图3 如果绝对零度时热力学系统的熵趋于一个定值(公式(8)),则两种不同的热力学平衡态(对应化学反应,就是反应物状态、生成物状态,在热力学第三定律中,这个结论推广至任意两个热力学平衡态)的熵如(a)图所示。这时有限次的恒温与恒熵操作(红线)无法让一个热力学系统到达绝对零度。反之,如果公式(8)不成立,则两个热力学平衡态的熵则如(b)图所示。此时可以通过有限次恒温与恒熵操作让一个热力学系统到达绝对零度。本图参考了文献[6]中的图4.1,很多其他教材上也有类似示意图
图3 如果绝对零度时热力学系统的熵趋于一个定值(公式(8)),则两种不同的热力学平衡态(对应化学反应,就是反应物状态、生成物状态,在热力学第三定律中,这个结论推广至任意两个热力学平衡态)的熵如(a)图所示。这时有限次的恒温与恒熵操作(红线)无法让一个热力学系统到达绝对零度。反之,如果公式(8)不成立,则两个热力学平衡态的熵则如(b)图所示。此时可以通过有限次恒温与恒熵操作让一个热力学系统到达绝对零度。本图参考了文献[6]中的图4.1,很多其他教材上也有类似示意图
4
热力学第三定律的内涵 前面提到,在能斯特的工作中,他从公式(15)出发得到了公式(16)与公式(17)两个结论。其中,公式(17)对应热力学第三定律,它有着丰富的物理内涵,我们下面从经典力学、量子力学两个层面来理解。但需要指出的是在这个工作完成的时间节点,也就是20世纪的第一个十年,量子力学还远没有成型。除了普朗克与爱因斯坦,能够接受并支持该理论的科学家并不多。能斯特是他们的重要盟友,一个一定程度上可以代表当时德国的化学届中物理化学领域的盟友15)。 1907年,爱因斯坦利用量子的概念解释了固体比热[15]。这是量子理论发展史中一个标志性工作,在一定程度上解决了开尔文爵士在19—20世纪之交提出的物理学中两朵乌云中的一朵 (比热) 对应的问题16)。能斯特深受鼓舞,并于1909年专门前往苏黎世拜访了爱因斯坦。他相信可以从量子理论中也找到能斯特定理的解释17)。1914年爱因斯坦从苏黎世搬到柏林,任职柏林大学。能斯特与普朗克一起,是劝说爱因斯坦接受柏林大学教职的关键人物 (图4)。从这次访问到20世纪第二个十年的中前期,爱因斯坦与能斯特的关系都非常融洽,后来有所恶化18)。 图4 能斯特与爱因斯坦
1911年,由能斯特作为主要发起者之一的第一届索尔维会议召开19)。同年,普朗克提出了一个能斯特定理的推论:当绝对温度趋于零时,固体和液体的熵也趋于零[16]。注意,这里普朗克强调的不光是一个物质的两个热平衡态在温度趋近于绝对零度时熵的差为零,而且是它们趋近的那个数本身也是零。这个知识点我们多数读者在学习热力学时都有印象,但需要说明的是,目前的一些前沿研究与之存在一定程度的冲突,最典型的例子就是量子相变 (零温下的相变) 问题中,系统的熵往往不为零。熵也是量子相变的一个重要的驱动力[17]。在经典理论的框架下,趋近绝对零度的固体和液体只处在一个构型20),熵为零。但对于低温下的量子体系而言,它的不同构型可以通过隧穿、量子涨落这样的量子现象联系起来。以图5所示的水分子团簇以及固态冰体系为例,隧穿可以把系统带到不同的构型。这种隧穿不光可以计算出,也可以测量出[18]。根据奥地利物理学家玻尔兹曼在1877年给出的玻尔兹曼关系:
热力学体系的熵在绝对零度趋近于一个非零的定值21)。换句话说,因为公式(18)中Ω为微观状态数,量子隧穿能够保障即使在绝对零度,在某些固体中依然可以存在不同构型之间由隧穿带来的相互转变,使得Ω不再为1,S也就不再为零。作为一个最典型的目前前沿研究中的例子,在冰相图的研究中,零点熵 (zero point entropy,也叫residual entropy) 就是一个在比较不同相的稳定性时必须考虑的因素[21]。
图4 能斯特与爱因斯坦
1911年,由能斯特作为主要发起者之一的第一届索尔维会议召开19)。同年,普朗克提出了一个能斯特定理的推论:当绝对温度趋于零时,固体和液体的熵也趋于零[16]。注意,这里普朗克强调的不光是一个物质的两个热平衡态在温度趋近于绝对零度时熵的差为零,而且是它们趋近的那个数本身也是零。这个知识点我们多数读者在学习热力学时都有印象,但需要说明的是,目前的一些前沿研究与之存在一定程度的冲突,最典型的例子就是量子相变 (零温下的相变) 问题中,系统的熵往往不为零。熵也是量子相变的一个重要的驱动力[17]。在经典理论的框架下,趋近绝对零度的固体和液体只处在一个构型20),熵为零。但对于低温下的量子体系而言,它的不同构型可以通过隧穿、量子涨落这样的量子现象联系起来。以图5所示的水分子团簇以及固态冰体系为例,隧穿可以把系统带到不同的构型。这种隧穿不光可以计算出,也可以测量出[18]。根据奥地利物理学家玻尔兹曼在1877年给出的玻尔兹曼关系:
热力学体系的熵在绝对零度趋近于一个非零的定值21)。换句话说,因为公式(18)中Ω为微观状态数,量子隧穿能够保障即使在绝对零度,在某些固体中依然可以存在不同构型之间由隧穿带来的相互转变,使得Ω不再为1,S也就不再为零。作为一个最典型的目前前沿研究中的例子,在冰相图的研究中,零点熵 (zero point entropy,也叫residual entropy) 就是一个在比较不同相的稳定性时必须考虑的因素[21]。
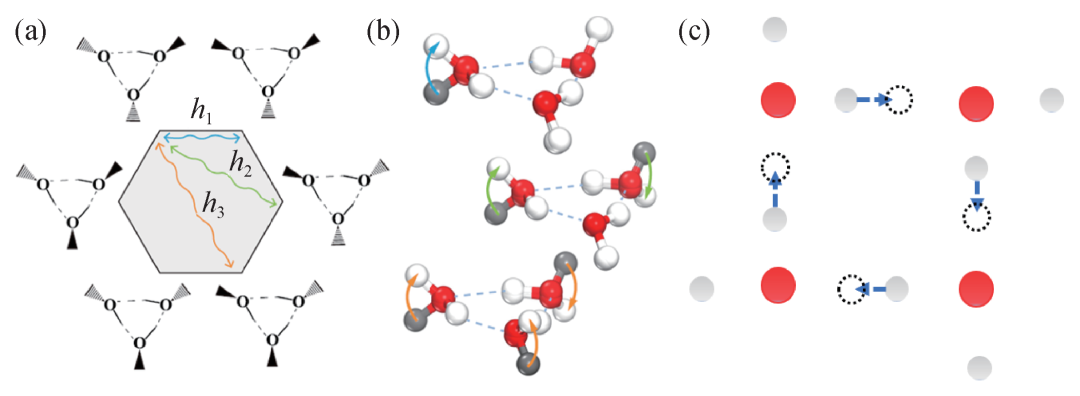 图5 实际材料中由量子隧穿联系起来的不同构型 (a)水的三聚体有6个等价构型;(b)这些构型间可以通过隧穿联系起来,隧穿强度对应于(a)图中的h1、h2、h3;(c)一个立方冰中,方格单元的氢键网络内部可以发生协同隧穿,把系统带到另外一个构型(基于文献[19]的图加工得到)。在(a),(b)与(c)对应的两个体系中,隧穿均可以把系统从一个构型带到另一个构型
除了熵,在能斯特的文章中,从公式(15)到公式(16)的推导还意味着化学反应前后反应物状态和生成物状态的比热在绝对零度时也相同。这个结论内涵也比较复杂,正确性同样值得讨论。应该说不管是在经典力学还是在量子力学的框架下,都有很多细节可以展开。本文题目是“热力学第三定律的发现过程及内涵浅析”,严格意义上讲,这个内涵浅析应该只包含对公式(17)的分析,因为这个公式是热力学第三定律的内容,公式(16)并不是。但考虑到公式(16)也是能斯特在其关键文章中的一个重要结论,本着尽量把科学知识的正确性分析透彻的原则,我们还是继续针对公式(16)进行一部分讨论。我们以一个最常见的放热反应为例,
并假设反应物、生成物状态为理想气体,讨论公式(16)在经典力学、量子力学框架下的正确性。
这里,我们先假设气相反应可以在绝对零度附近发生,然后对照公式(16),讨论在经典力学、量子力学图像下这个气相反应的反应物、生成物两种热平衡状态的比热的变化。
讨论的基础是双原子气体分子H2、O2的摩尔比热在经典图像、量子图像下随温度的变化 (图6)。这里要用到的知识点是它们都有三个平动自由度、两个转动自由度。在高温下理想气体状态时,这些自由度不受限,每个自由度在温度T下的能量为kBT/2,一共5kBT/2。除此之外,还有一个振动自由度,在这个自由度上有势能限制。根据位力定理 (Virial theorem),再贡献kBT的能量。因此,高温下双原子气体分子的总能量是7kBT/2,摩尔比热是7NAkB/2。之后,随着温度的降低,先是振动自由度被冻住,能量降为5kBT/2,摩尔比热降为5NAkB/2。再往后,两个转动自由度被冻住,能量降为3kBT/2,摩尔比热降为3NAkB/2。因此,如果该理想气体可以在绝对零度附近存在,其摩尔比热为3NAkB/2。这样的话,在低温、量子力学的情况下,反应物有两摩尔H2、一摩尔O2,总比热为9NAkB/2。
图5 实际材料中由量子隧穿联系起来的不同构型 (a)水的三聚体有6个等价构型;(b)这些构型间可以通过隧穿联系起来,隧穿强度对应于(a)图中的h1、h2、h3;(c)一个立方冰中,方格单元的氢键网络内部可以发生协同隧穿,把系统带到另外一个构型(基于文献[19]的图加工得到)。在(a),(b)与(c)对应的两个体系中,隧穿均可以把系统从一个构型带到另一个构型
除了熵,在能斯特的文章中,从公式(15)到公式(16)的推导还意味着化学反应前后反应物状态和生成物状态的比热在绝对零度时也相同。这个结论内涵也比较复杂,正确性同样值得讨论。应该说不管是在经典力学还是在量子力学的框架下,都有很多细节可以展开。本文题目是“热力学第三定律的发现过程及内涵浅析”,严格意义上讲,这个内涵浅析应该只包含对公式(17)的分析,因为这个公式是热力学第三定律的内容,公式(16)并不是。但考虑到公式(16)也是能斯特在其关键文章中的一个重要结论,本着尽量把科学知识的正确性分析透彻的原则,我们还是继续针对公式(16)进行一部分讨论。我们以一个最常见的放热反应为例,
并假设反应物、生成物状态为理想气体,讨论公式(16)在经典力学、量子力学框架下的正确性。
这里,我们先假设气相反应可以在绝对零度附近发生,然后对照公式(16),讨论在经典力学、量子力学图像下这个气相反应的反应物、生成物两种热平衡状态的比热的变化。
讨论的基础是双原子气体分子H2、O2的摩尔比热在经典图像、量子图像下随温度的变化 (图6)。这里要用到的知识点是它们都有三个平动自由度、两个转动自由度。在高温下理想气体状态时,这些自由度不受限,每个自由度在温度T下的能量为kBT/2,一共5kBT/2。除此之外,还有一个振动自由度,在这个自由度上有势能限制。根据位力定理 (Virial theorem),再贡献kBT的能量。因此,高温下双原子气体分子的总能量是7kBT/2,摩尔比热是7NAkB/2。之后,随着温度的降低,先是振动自由度被冻住,能量降为5kBT/2,摩尔比热降为5NAkB/2。再往后,两个转动自由度被冻住,能量降为3kBT/2,摩尔比热降为3NAkB/2。因此,如果该理想气体可以在绝对零度附近存在,其摩尔比热为3NAkB/2。这样的话,在低温、量子力学的情况下,反应物有两摩尔H2、一摩尔O2,总比热为9NAkB/2。
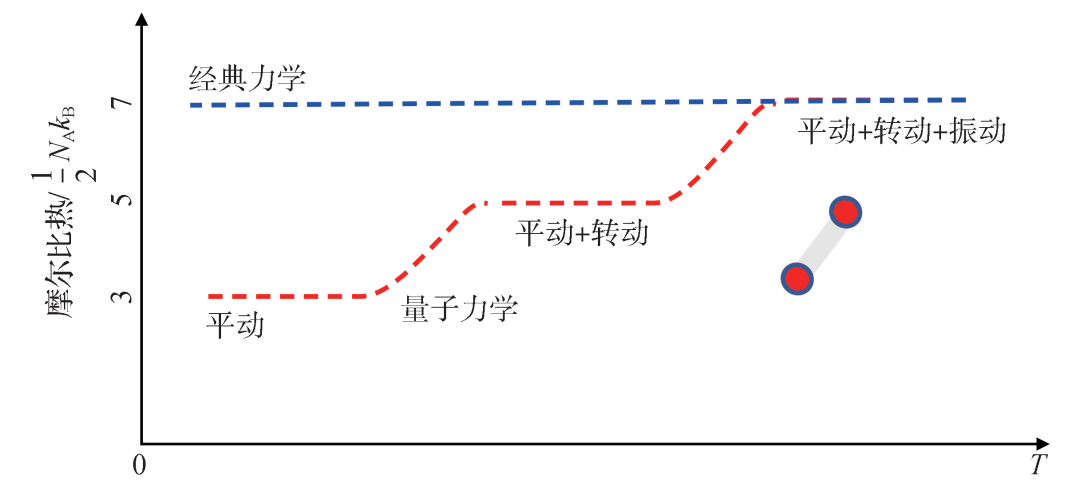 图6 双原子分子的摩尔比热随温度变化示意图,红色虚线对应量子力学图像,蓝色虚线对应经典力学情况
之后,我们看H2O以理想气体存在时其比热的情况 (图7)。三个平动自由度,三个转动自由度,三个振动自由度 (一个剪刀模式,两个伸缩模式) 。其中平动与转动在理想气体模型中的高温下贡献6个自由度,对应3kBT的能量,3NAkB的摩尔比热。三个振动模式贡献3kBT的能量,3NAkB的摩尔比热。一共是6kBT的能量,6NAkB的摩尔比热。之后,随着温度降低,三个振动模式首先被冻住,摩尔比热变为3NAkB。再然后三个转动模式被冻上,摩尔比热变为3NAkB/2。低温下,只有三个平动自由度。两摩尔H2与一摩尔O2生成两摩尔H2O,因此是3NAkB的比热。
图6 双原子分子的摩尔比热随温度变化示意图,红色虚线对应量子力学图像,蓝色虚线对应经典力学情况
之后,我们看H2O以理想气体存在时其比热的情况 (图7)。三个平动自由度,三个转动自由度,三个振动自由度 (一个剪刀模式,两个伸缩模式) 。其中平动与转动在理想气体模型中的高温下贡献6个自由度,对应3kBT的能量,3NAkB的摩尔比热。三个振动模式贡献3kBT的能量,3NAkB的摩尔比热。一共是6kBT的能量,6NAkB的摩尔比热。之后,随着温度降低,三个振动模式首先被冻住,摩尔比热变为3NAkB。再然后三个转动模式被冻上,摩尔比热变为3NAkB/2。低温下,只有三个平动自由度。两摩尔H2与一摩尔O2生成两摩尔H2O,因此是3NAkB的比热。
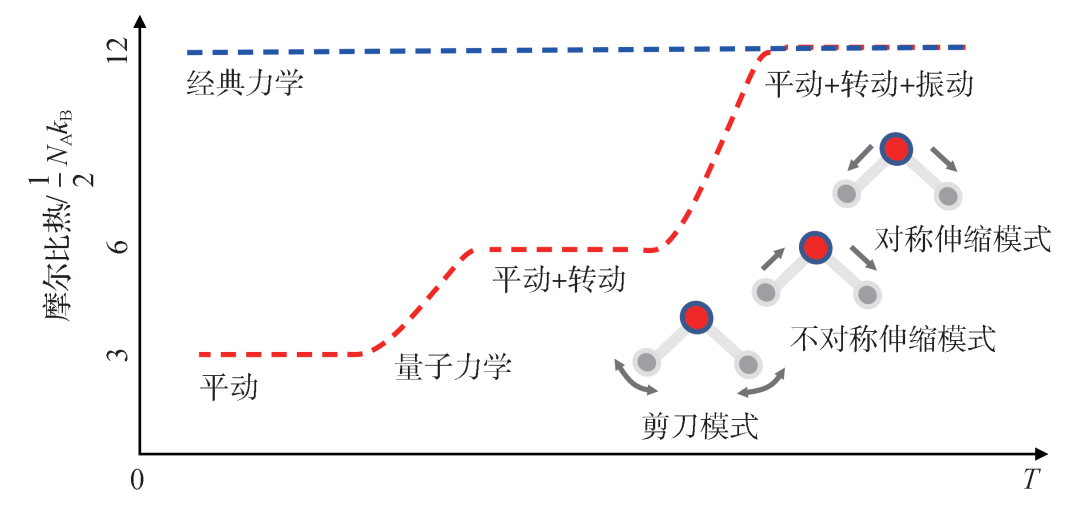 图7 H2O分子的摩尔比热随温度变化示意图,红色虚线对应量子力学图像,蓝色虚线对应经典力学情况
换句话说,在这个理想实验的量子力学图像下,反应物状态与生成物状态的焓差在绝对零度附近是3kBT/2,比热的差是3NAkB/2,不是零。这与能斯特文章中的结论 (比热不发生变化,公式(16)) 是不一致的。在经典力学的图像下(图(6),(7)的蓝色虚线),反应物状态的总比热为3×7NAkB/2,生成物状态的总比热为12NAkB。比热同样也发生变化。因此,能斯特文章中公式(16)这个结论,如果假想气相反应可存在到绝对零度附近,不论在经典力学还是在量子力学框架下,正确性都是有待商榷的。
最后再讨论一下传统的固体,因为真实情况下,绝对零度附近实际气体会凝聚,所有的自由度在绝对零度附近都会被冻住,进而热容为零。比如我们熟悉的金属中自由电子费米气体以及晶体中的理想声子气体,它们在绝对零度附近的比热容为
图7 H2O分子的摩尔比热随温度变化示意图,红色虚线对应量子力学图像,蓝色虚线对应经典力学情况
换句话说,在这个理想实验的量子力学图像下,反应物状态与生成物状态的焓差在绝对零度附近是3kBT/2,比热的差是3NAkB/2,不是零。这与能斯特文章中的结论 (比热不发生变化,公式(16)) 是不一致的。在经典力学的图像下(图(6),(7)的蓝色虚线),反应物状态的总比热为3×7NAkB/2,生成物状态的总比热为12NAkB。比热同样也发生变化。因此,能斯特文章中公式(16)这个结论,如果假想气相反应可存在到绝对零度附近,不论在经典力学还是在量子力学框架下,正确性都是有待商榷的。
最后再讨论一下传统的固体,因为真实情况下,绝对零度附近实际气体会凝聚,所有的自由度在绝对零度附近都会被冻住,进而热容为零。比如我们熟悉的金属中自由电子费米气体以及晶体中的理想声子气体,它们在绝对零度附近的比热容为
 这里εF为费米能级,θD为德拜特征温度。换句话说,如果反应物、生成物在绝对零度下都以固体形式存在的话,在量子力学的图像下,它们各自的比热在绝对零度附近会趋于零,比热差在绝对零度附近肯定也等于零 (图8)。这时,能斯特文章中的推论 (公式(16)) 是成立的。在经典图像下,固体中每个原子的自由度都在三个方向受限,因此位力定理对各个自由度的影响是一样的。再加上化学反应前后原子数并不发生变化,在经典图像下虽然比热本身不为零,反应前后的比热也不发生变化。当然,化学反应的反应物和生成物在绝对零度附近也可以对应量子液体。量子液体的比热随温度应该会有更加新奇一些的行为。这个讨论,应该说是远远超出了能斯特在其文章中想要讨论的物理含义,这里不再过度展开,读者可以进一步思考。
这里εF为费米能级,θD为德拜特征温度。换句话说,如果反应物、生成物在绝对零度下都以固体形式存在的话,在量子力学的图像下,它们各自的比热在绝对零度附近会趋于零,比热差在绝对零度附近肯定也等于零 (图8)。这时,能斯特文章中的推论 (公式(16)) 是成立的。在经典图像下,固体中每个原子的自由度都在三个方向受限,因此位力定理对各个自由度的影响是一样的。再加上化学反应前后原子数并不发生变化,在经典图像下虽然比热本身不为零,反应前后的比热也不发生变化。当然,化学反应的反应物和生成物在绝对零度附近也可以对应量子液体。量子液体的比热随温度应该会有更加新奇一些的行为。这个讨论,应该说是远远超出了能斯特在其文章中想要讨论的物理含义,这里不再过度展开,读者可以进一步思考。
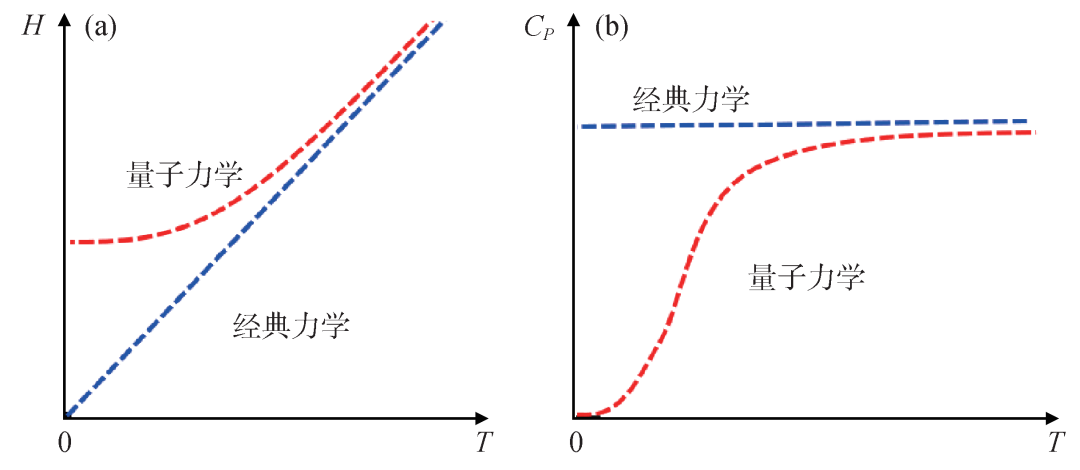 图8 固体的焓(a)与比热(b)在量子力学(红色虚线)、经典力学(蓝色虚线)图像下随温度的变化示意图
图8 固体的焓(a)与比热(b)在量子力学(红色虚线)、经典力学(蓝色虚线)图像下随温度的变化示意图
5
总 结 在热力学第三定律的诞生过程中,在当时新兴的物理化学这个学科领域,基于热力学基本原理对化学反应的研究在其中扮演了最为重要的角色。正如能斯特在1906年末的声明所述,从反应热的测量出发对化学平衡进行计算的探索过程是热化学研究的目标。在这个过程中,热力学第三定律浮出水面。而能斯特本人,也成为了热力学第三定律发现过程中最关键的人物。之后,能斯特定理演化为热力学第三定律,它是普适的,具有深刻的物理内涵。与能斯特定理平行,文章中也提到了热容的性质。这个性质现在看的话,有比较多可以商榷的地方。历史上,人们关于一个实际体系的热容研究对于量子力学的发展同样重要。作为物理学从业人员,我们应该了解热力学第三定律这个热力学理论中的一个基本定律的产生历史。从中我们不仅能够感受到学科交叉研究在基础科学重大发现中所产生的促进作用,也体会学科交叉绝不是单向的、简单的拼凑相加,而是彼此相融的有机结合。了解这些历史,对我们今后认识自然界或许会有帮助在热力学第三定律的诞生过程中,在当时新兴的物理化学这个学科领域,基于热力学基本原理对化学反应的研究在其中扮演了最为重要的角色。正如能斯特在1906年末的声明所述,从反应热的测量出发对化学平衡进行计算的探索过程是热化学研究的目。 致 谢 感谢文章写作过程中北京大学高原宁院士、全海涛教授、蒋鸿教授关键的指导与帮助。 注1)在理论体系中,theorem与law的逻辑地位完全不同。theorem是在一个理论体系中的某种性质,非一眼可见,却可以从某些出发点推出。在能斯特1906年的文章中,∆S在绝对零度时趋于零的结论能够以∆G(化学反应时,化学反应体系从反应态到生成态的自由能变化)对温度的偏微分在趋近绝对零度时为零作为出发点推出。因此,在能斯特最早的文章中,它是一个theorem。Law则是对经验的理性总结,之后作为某理论体系的出发点。有些law后期可以被更为基本的理论导出,这时,严格意义上它在这个理论体系中就不应该再被称为law了。Nernst theorem提出后,随着热力学理论的发展,人们认识到在热力学理论体系中,它其实应该被赋予law的地位。因此,能斯特热定理在后来被正式命名为热力学第三定律。这个逻辑关系,在作者看来,对于物理学理论的学习非常重要。
2)热力学第三定律可以由量子统计力学导出,但在热力学理论的框架下,它本身是完全独立于另外三个定律的。 3)理查兹于1914年获得诺贝尔化学奖,他的获奖理由并不是因为化学反应热的研究,而是因为化学反应中原子质量的精确测量。 4)理查兹在1902年提出,在绝对零度时化学反应的焓变与自由能变化有相等的趋势,尽管当时他基于的实验数据并不完全是他自己的,多数来自当时已发布的文献,但不可否认的是,正是因为有了类似精确的测量技术,才有了这些实验数据。具体到1902年理查兹的文章引用的数据,与焓变相关的数据来自量热法,与自由能变化相关的数据来自电化学实验的输出功的测量。 5)吉布斯这些文章的写作风格非常抽象,加之他本人在美国,与欧洲主流学界在空间上比较隔离,这就造成了他的理论在当时被多数欧洲同行忽视,但也引起了像麦克斯韦、瑞利、奥斯特瓦尔德等人的关注。 6)对应的就是现在的相图,虽然“相”的概念是吉布斯在探讨混合液体的平衡(第三个工作)时才引入。 7)文章题目正体现了这一思想,这里关键词为geometrical representation。 8)之前人们用“态”来描述物质的存在形式,比如液态、气态、固态。在混合液体的研究中,吉布斯意识到同样是液态,内部物质的存在形式也不同。因此要引入“相”的概念来加以区别。不同的液体相混合,整体都是液态,但在这个液态内部,有“相”之间的平衡。后来,在磁性问题的研究中,人们也认识到固态内部可以有铁磁、顺磁等不同的相。人们基于范德瓦耳斯模型描述的“态”之间的转变也升级为由伊辛模型描述的“相”之间的转变。更多讨论见文献[13]。 9)有些文献在描述人们对化学反应的热力学研究时,会强调丹麦化学家汤姆森(Julius Thomsen,1826—1909)和法国化学家贝特洛(Marcellin Berthelot,1827—1907)的贡献。他们贡献可以总结为:化学反应向着放热方向进行。这是一个经验总结,也被称为Thomsen—Berthelot原理。我们想强调一下,正是由于人们发现这个原理并不是对所有的化学反应成立(因为有自发的吸热反应),才让人们认识到了熵的贡献,进而总结出“化学反应应该是向着自由能降低的方向进行”这样一个规律。自由能降低这个判据相比于放热这个判据,引入的因素恰恰是熵。而理查兹和能斯特关注的焓变与自由能变化的差,也是温度乘以熵变。从这个意义上来说,Thomsen—Berthelot原理是一个被证伪的经验总结。但它确实也在热力学第三定律的发现过程中的某个阶段扮演过相对重要的角色。 10)这个bound energy被翻译为束缚能或许并不合适,因为束缚能经常是指binding energy(有时也叫结合能),是两个粒子形成束缚态时系统能量的降低。有时,束缚能又被理解为从原子中剥离一个电子所需能量。这里,亥姆霍兹的意思是这个能量不能被“自由”地转化为功,它是相对于自由能(free energy)来说的。 11)19世纪末人们已经很清楚地认识到焓与热的关系。我们现在使用的enthalpy(焓)这个词,是1909年由荷兰物理学家昂内斯给出的。它来源于希腊语,意思是warm within。 12)历史上,在利用热力学描述化学反应时,多数人用的并不是吉布斯的语言,但他们的语言与吉布斯的语言有等价关系。比如范特霍夫,他不用熵,但熵与范特霍夫用的负自由能对温度的偏微分,是等价的。 13)当时人们测量ΔG有两种方法。一种是利用化学反应平衡常数,这类实验非常枯燥且难度极高。另一种是针对电化学反应,直接测量电压,从输出功求得,这类实验要方便很多。1902年理查兹的文章采用的主要是电化学实验数据。ΔH的测量主要通过反应热,理查兹也是前面提到化学反应量热法方面的专家。 14)当时能斯特也正处在从哥廷根大学转聘至柏林大学工作的过程中。 15)关于物理化学,大家可以简单的理解为从原子、分子的层面去理解化学。这是本文作者李新征在2012—2013年刚回国时,从中国科学技术大学郑晓教授(最近转到复旦大学化学系)那里了解到的。 16)这个问题又恰恰与从公式(15)出发得到公式(16)对应的结论相关,我们在讨论完公式(17)对应的热力学第三定律后,再回来针对其进行讨论。 17)能斯特的直觉是正确的,现在从量子统计可以直接推出热力学第三定律。 18)这要等到20世纪的第二个十年的中期,按爱因斯坦的说法,他认为能斯特过于霸道。 19)能斯特彼时任柏林大学第二化学研究所主任,也是来自比利时的实业家欧内斯特·索尔维(Ernest Solvay,1838—1922)的朋友。能斯特是索尔维会议最重要的发起人之一,正是他说服索尔维对会议进行资助。 20)对于经典伊辛模型对应的铁磁体,即使有向上、向下两个状态,系统也只处在其中一个。 21)在这里有两点需要说明。第一是我们讨论的还是一个基于经典构型,但是考虑了量子隧穿,进而可以让系统从一种构型转变为另一种构型的情况。在这里,系统具有多个最低能量状态,隧穿允许系统在不同的最低能量状态之间转变,进而带来非零的“零点熵”。一个纯量子体系,熵的描述需要借助冯·诺伊曼的定义,我们这里的讨论对应的不是纯量子情况。第二点就是在这种情况下,影响构型熵的因素,比如零点能、隧穿速率,在趋近于绝对零度时也会趋近于一个定值。关于这一点具体的讨论可参考文献[20]的第七章。 参考文献 [1] Schilpp P A. A Einstein:Philosopher Scientist. La Salle,IL.:Open Court Publishing,1973 [2] Einstein A. Autobiographical Notes. In:Schilpp P A (ed.). A Centennial Edition. Open Court Publishing Company,1979. p.31 [3] 祁天杰,尹晓冬 . 科学文化评论,2020,17 (04):87 [4] Laidler K J. The World of Physical Chemistry. Oxford University Press,1993.p.108 [5] Coffey P. Historical Studies in the Physical and Biological Sciences,2006,36(2):365 [6] 刘川. 热力学与统计物理. 北京:北京大学出版社,2022 [7] 林宗涵 . 热力学与统计物理学(第二版). 北京:北京大学出版社,2018 [8] Nernst W. Über die Berechnung chemischer Gleichgewichte aus thermischen Messungen,Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen,Mathematisch-Physikalische Klasse. 1906,pp.1—40 [9] Gibbs J W. Transactions of the Connecticut Academy,1873,II:309 [10] Gibbs J W. Transactions of the Connecticut Academy,1873,II:382 [11] Gibbs J W. Trans. Conn. Acad. Arts Sci.,1875-1876,3:108 [12] Gibbs J W. Trans. Conn. Acad. ArtsSci.,1877-1878,3:343 [13] 叶 麒 俊 ,欧 阳 霄 宇 ,李 新 征 . 物 理 ,2023,52:786 [14] Richard T W. Proc. Am. Acad. Arts Sci.,1902,38(7):293 [15] Einstein A. Ann. Phys.,1907,22:180 [16] Planck M. Thermodynamik,3rd ed. Berlin:De Gruyter,1911 [17] 陈越,陈晓松. 量子相变简介,2024-05-27,https://mp.weixin.qq.com/s/OnpHis-2ZTHo0DujLbLgpcg [18] Zhu Y C,Yang S,Zeng J X et al. J. Am. Chem. Soc.,2022,144:21356 [19] Drechsel-Grau C,Marx D. Nat. Phys.,2015,11:216 [20] 李新征,王恩哥 . 分子及凝聚态系统物性的计算模拟:从电子结构到分子动力学 . 北京:北京大学出版社,2014. p.180 [21] Herrero C P,Ramírez R. Chem. Phys. Lett.,2013,70:568 本文经授权转载自微信公众号“中国物理学会期刊网”,选自《物理》2024年第11期。本站内容收集整理于网络,多标有原文出处,本站仅提供信息存储空间服务。如若转载,请注明出处。